MODELOS ATOMICOS
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración. |
| ||||||||||||||||||||||||||||||||||||||||||||
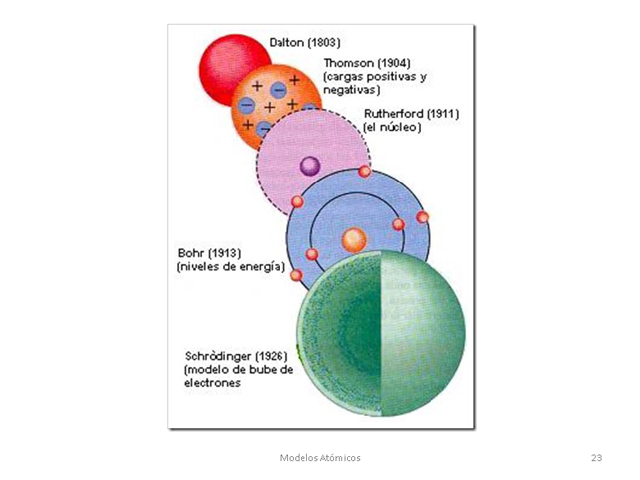
Un modelo atómico es una representación estructural de un átomo, que trata de explicar su comportamiento y propiedades. De ninguna manera debe ser interpretado como un dibujo de un átomo, sino más bien como el diagrama conceptual de su funcionamiento. A lo largo del tiempo existieron varios modelos atómicos y algunos más elaborados que otros:
- Modelo atómico de Demócrito, el primer modelo atómico, postulado por el filósofo griego Demócrito.
- Modelo atómico de Dalton, que surgió en el contexto de la química, el primero con bases científicas.(1803)
- Modelo atómico de Thomson, o modelo del budín, donde los electrones son como las "frutas" dentro de una "masa" positiva.(1904)
- Modelo del átomo cúbico de Lewis, donde los electrones están dispuestos según los vértices de un cubo, que explica la teoría de la valencia.
- Modelo atómico de Rutherford, el primero que distingue entre el núcleo central y una nube de electrones a su alrededor.(1911)
- Modelo atómico de Bohr, un modelo cuantizado del átomo, con electrones girando en órbitas circulares.(1913)
- Modelo atómico de Sommerfeld, una versión relativista del modelo de Rutherford-Bohr.
- Modelo atómico de Schrödinger, un modelo cuántico no relativista donde los electrones se consideran ondas de materia existente.
1. Modelo Atómico de Dalton (1808): Representa al átomo como un esfera compacta indivisible e indestructible. Dalton presenta los siguientes postulados acerca del átomo:

- El átomo es la mínima porción de materia que no puede dividirse por ningún proceso conocido.
- Los átomos de un mismo elemento son iguales tanto en masa, tamaño como en sus demás propiedades.
- Los átomos de elementos diferentes son también diferentes en todas sus propiedades.
- Los átomos se combinan entre sí en relaciones enteras sencillas para formar compuestos.
Actualmente:
- El primer postulado ya no se ajusta a la realidad por el descubrimiento de las partículas subatómicas: electrón, protón y neutrón.
- El 2º y 3º postulado ya no se cumple con el descubrimiento de los isótopos e isóbaros respectivamente.
- El 4º postulado se cumple hoy. Por ejemplo, el agua se forma por la combinación de 2 átomos de H y un átomo de O, quedando la relación entre ellos como: H2O
2. Modelo Atómico de Thomson (1898): Representa al átomo como una especie de esfera homogénea de electricidad positiva, en donde se encuentran distribuidos los electrones, atraídos electrostáticamente, en número suficiente para que el conjunto resultara neutro. Su modelo atómico lo asemeja a un budín de pasas.

El átomo que representa éste modelo es un átomo estacionario por la inmovilidad que presentan los electrones.

3. Modelo Atómico de Rutherford (1911): Basado en el descubrimiento del núcleo atómico, Rutherfordestablece un modelo para el átomo de hidrógeno.
Donde:
- El átomo está constituido por un núcleo central que es la región donde se encuentran las cargas positivas, y alrededor se encuentra el electrón.
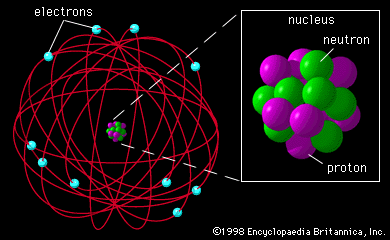
- El electrón se encuentra girando alrededor de del núcleo; describiendo órbitas circulares de forma similar a los planetas que giran alrededor del sol; denominándose Sistema planetario en miniatura.
- La fuerza centrífuga que desarrolla al girar el electrón, contrarresta la fuerza de atracción electrostática que ejerce el núcleo (+) sobre el electrón (-).
- El diámetro del átomo es aproximadamente unas 10000 veces mayor que el diámetro del núcleo. Por lo tanto, el átomo es prácticamente hueco, al poseer espacios interatómicos.
Error de Rutherford: Según la física clásica un cuerpo cargado eléctricamente al estar en movimiento este emite energía; por lo tanto, el electrón perderá energía y caería hacia el núcleo con una trayectoria de espiral, lo que no sucede con la experiencia.La solución a este problema la dió en 1913 Niels Bohr basándose en la teoría Cuántica de la radiación electromagnética, dada a conocer por Max Planck.
En 1913 Niels Bohr discípulo de Rutherford propone un nuevo modelo para el átomo de Hidrógeno aplicando acertadamente la teoría Cuántica de la radiación de Planck. Su modelo está basado en los siguientes postulados:
- El átomo de hidrógeno consta de un núcleo (+) y a su alrededor gira en forma circular un electrón (-), de tal manera que la fuerza centrífuga contrarreste la fuerza de atracción electrostática.
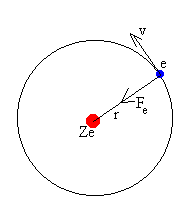
- El electrón sólo gira en determinadas órbitas de radios definidos, llamados también niveles cuantificados de energía.
 En 1913 Niels Bohr discípulo de Rutherford propone un nuevo modelo para el átomo de Hidrógeno aplicando acertadamente la teoría Cuántica de la radiación de Planck. Su modelo está basado en los siguientes postulados:
En 1913 Niels Bohr discípulo de Rutherford propone un nuevo modelo para el átomo de Hidrógeno aplicando acertadamente la teoría Cuántica de la radiación de Planck. Su modelo está basado en los siguientes postulados:- El átomo de hidrógeno consta de un núcleo (+) y a su alrededor gira en forma circular un electrón (-), de tal manera que la fuerza centrífuga contrarreste la fuerza de atracción electrostática.

- El electrón sólo gira en determinadas órbitas de radios definidos, llamados también niveles cuantificados de energía.
- Mientras los electrones permanezcan en un mismo nivel de energía (llamados estados estacionarios por Bohr) no ganan ni pierden energía.
- Un electrón puede cambiar de un nivel a otro dentro de un mismo átomo ganando o perdiendo una cantidad de energía igual a la diferencia existente entre ambos estados. De este modo, todo cambio energético del electrón corresponderá a saltos que haga entre los estados estacionarios.
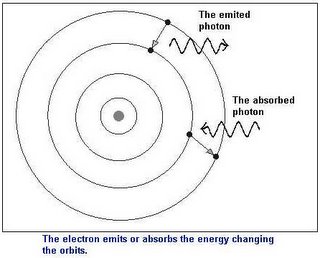
- Un átomo sólo emite energía cuando un electrón salta de un nivel de energía superior a otro inferior y absorbe energía en caso contrario. La energía emitida o absorbida por el átomo recibe el nombre de fotón o cuanto de luz.
Observaciones:
Niels Bohr llegó a establecer una ecuación que permitió calcular la energía potencial de cada nivel energético del átomo de hidrógeno, tomando en cuenta factores como la masa y la carga eléctrica del electrón. En dicha ecuación se representa al nivel de energía mediante una letra “n” a la que se le da el nombre de número cuántico principal y que distingue a los niveles de energía. Así, a cada uno de los diferentes niveles de energía le corresponderá un determinado valor “n”. Estos valores son números enteros (1, 2, 3, 4, etc). Los átomos de los elementos más grandes que se conocen actualmente tienen un máximo de 7 niveles y, por ello, el valor máximo de “n” para esos es 7.
Bohr relaciona, así, los estados estacionarios 1, 2, 3, 4, etc., con las llamadas capas electrónicas K, L, M, N, O, P y Q, y estableció que el número máximo de electrones de una órbita o nivel de energía “n” era igual a 2n2.
Niels Bohr logró explicar, gracias a su modelo, las líneas espectrales del átomo de H; con el tiempo su teoría sufrió muchas modificaciones, pero le cabe el mérito de haber orientado las investigaciones posteriores al fundar la mecánica cuántica.
Niels Bohr logró explicar, gracias a su modelo, las líneas espectrales del átomo de H; con el tiempo su teoría sufrió muchas modificaciones, pero le cabe el mérito de haber orientado las investigaciones posteriores al fundar la mecánica cuántica.
Nota: Las líneas espectrales del átomo de hidrógeno son las transiciones o saltos de los electrones de uno a otro nivel de energía. Estas emisiones u absorciones de energía pueden captarse en los llamados espectros.
- Espectro de líneas de emisión: Son líneas brillantes de diferentes colores que se emiten cuando se produce una carga eléctrica sobre el hidrógeno.
- Espectro de líneas de absorción: Son líneas oscuras que se originan cuando se hace incidir la luz blanca sobre el hidrógeno gaseoso.
Restricciones del modelo de Bohr:
- No puede explicar los espectros observados para átomos multielectrónicos (más de un electrón).
- Sólo es aplicable para átomos.
by:f.C











